
时间:2022-04-02 11:30:55 浏览:807次
A1 流行率和检测
乙型肝炎病毒的流行率是多少?
乙型肝炎病毒(HBV)是一种包膜DNA病毒,属于嗜肝DNA病毒家族。乙型肝炎病毒可引起急性和慢性感染,范围从无症状感染或轻度疾病到严重或重型肝炎。2015年,全球普通人群HBV感染率为3.5%。非洲(6.1%)、西太平洋地区(6.2%)和东地中海地区(3.3%)的患病率最高。在欧洲,2017年有30个成员国报告了26907例HBV感染病例,相当于每10万人口6.7例的粗略比率。20个国家报告了HBV慢性感染,导致每10万人口中的总报告率为7.2例。2017年,英国报告了62%的慢性病病例(ECDC,2017年)。总体而言,约有2.57亿人感染了HBV。然而,慢性乙型肝炎病例的发病率取决于当地的通报要求。许多感染者仍未确诊。在乙肝疫苗接种之前出生的人中,慢性乙肝病毒感染者的比例仍然很高。大约15-40%的慢性感染患者会发展为肝硬化、肝衰竭或肝细胞癌,15-25%的患者最终会死于HBV感染。HBV感染导致的死亡率正在增加,并有望进一步增加。
2016年,世界卫生大会通过了关于病毒性肝炎的全球卫生部门战略(GHSS),承诺到2030年消除作为公共卫生威胁的病毒性肝炎。预防、检测和治疗的协同干预是有效肝炎反应的核心,并通过病毒性肝炎GHSS进行推广。假设育龄妇女占世界人口的25.3%(联合国数据),慢性感染的成年人可能包括6500万育龄妇女,她们可能会将HBV传染给婴儿(Lavanchy和Kane,2016)。HBV感染的大部分疾病负担来自5岁之前获得的感染(ECDC,2017)。因此,预防HBV感染的重点是5岁以下的儿童。20世纪90年代,世界卫生大会已经要求将乙肝疫苗纳入常规婴儿免疫计划。目前5岁以下儿童慢性HBV感染的低发病率可归因于乙型肝炎疫苗的广泛使用。2015年,全球范围内,这一年龄组的HBV感染率估计约为1.3%,而疫苗接种前时代的HBV感染率约为4.7%(根据引入年份,疫苗接种前时代的范围从20世纪80年代到21世纪初)。因此,目前大多数HBV感染者都是在乙型肝炎疫苗普及并在婴儿期使用之前出生的人。然而,覆盖范围存在区域差异。非洲、东地中海和欧洲地区仍低于全球平均水平(世卫组织,2017年)
在医疗辅助生殖之前,应该如何进行乙肝状态检测?
血清学检测通常被用作筛选病毒暴露的第一条检测策略,因为其成本相对较低(与核酸检测(NAT)相比)。检测乙型肝炎(HB)e抗原和抗-HBe抗体的血清学试验也可能有助于患者的管理,并且广泛可用。对于成人、青少年和儿童(>12个月大)慢性HBV感染的诊断,应采用符合最低质量的血清学分析(快速诊断试验(RDT)或实验室免疫分析格式(酶免疫分析或化学发光免疫分析),建议采用安全性和性能标准(关于分析和临床敏感性和特异性)检测乙肝表面抗原(HBsAg)。在现有实验室检测已经可用且可访问的环境中,建议将基于实验室的酶免疫分析(EIA)作为首选分析格式。通常由分析制造商确定的截止值指定了结果被视为反应的点,因此,EIA结果通常以光密度除以分析截止值(OD/CO)的形式报告。这些类型的分析最适合在高通量(每天超过40份)的环境中进行,且最具成本效益。在实验室检测机会有限的环境中,和/或在快速检测有助于与护理和治疗联系的人群中,建议使用RDT以改善获取机会。
-在HBsAg血清阳性率为≥0.4%,在进一步评估HBV DNA和肝病分期之前,建议采用单一血清学检测HBsAg。
-在HBsAg血清流行率低于0.4%的环境或人群中,可以考虑通过中和步骤或第二种不同的RDT检测HBsAg的相同免疫分析来确认HBsAg阳性。有条件推荐,证据质量低
在HBsAg血清学检测呈阳性后,推荐使用定量或定性NAT检测HBV DNA作为首选策略,并根据2015年世卫组织HBV管理指南(世卫组织,2015)的现有建议,指导世卫组织在没有肝硬化证据的情况下治疗或不治疗,以及监测治疗反应。这些分析检测病毒核酸的存在——通过针对特定病毒片段的DNA,然后进行扩增。扩增步骤可以检测原始样本中的低水平病毒,否则可能无法检测到。血清HBV DNA以国际单位(IU)/mL作为公认的国际标准进行测量,或通过NAT以拷贝/mL进行测量。HB核心抗体(HBcAb)是过去HBV暴露的标志物,指南审查没有寻找这种特定抗体的证据。
结论
根据欧洲组织和细胞指令,HBV检测是强制性的,作为一种预防措施,以降低向伴侣和后代传播的风险。、
A2 在医疗辅助生殖之前预防传播
PICO问题:通过阴道/肛交传播乙肝病毒的风险是什么?
根据
一项横断面研究包括203名乙型肝炎病毒(HBV)检测呈阳性的参与者及其138名性伙伴,对HBV抗原(Ag)和抗体(Ab)进行检测,以确定HBV指数病例性伙伴中当前和过去的HBV感染情况。在138名性伴侣中,28人(20.3%)接种了HBV疫苗,20人(14.5%)HBsAg检测呈阳性,36人(26.1%)有过去和当前HBV感染的证据。与男性伴侣相比,女性性伴侣更容易感染(粗OR 2.31,95%CI 1.01至5.29)。此外,与未同居的性伴侣相比,同居伴侣更容易感染(或3.95,95%可信区间1.73至9.04)(Tufon等人,2019年)。
一项大型横断面研究包括2590名HBsAg检测呈阳性的个体及其1454名配偶(1003名女性和451名男性),测量了所有伴侣的血清样本中的HBsAg,并报告了HBV暴露率(HB核心抗原(HBcAb)阳性)在女性配偶中为48%(n=480),在男性配偶中为62.9%(n=281)。然而,只有2.3%(n=33)的配偶HBsAg呈阳性(丈夫为4.2%,妻子为1.4%)(Katoonizadeh等人,2018年)。一项小型队列研究包括5例HBV及其伴侣(已婚或订婚)检测呈阳性的指标病例,并调查配偶之间的HBV序列同源性。在所有五对夫妇中,HBV感染指数受试者和配偶在克隆区域的序列同源性为100%(Hoo等人,1998年)。
一项包括83名急性HBV感染患者的旧研究调查了这些患者的性传播,发现其中18/24的性伴侣HBsAg和HBV DNA检测呈阳性(Hou等人,1993年)。
一项包含1368名女性的横断面研究报告,在27%的HBV检测阳性女性中,异性传播是获得疾病的唯一风险因素。此外,肛交和未使用屏障避孕药可能会促进HBV感染向女性传播(Rosenblum等人,1992年)。
一项前瞻性队列研究,包括68名HBsAg检测呈阳性的孕妇及其丈夫,调查了伴侣之间的性传播,报告显示,68名丈夫中有30名呈阳性(44.2%),11.8%呈Ag阳性,32.4%呈Ab阳性。此外,他们得出的结论是,如果性接触发生在月经期间或月经后立即,传播就会发生(Inaba等人,1979年)。
正式建议
乙型肝炎病毒(HBV)阳性个体的伴侣应接种疫苗。 (坚强的⊕)
在HBV疫苗接种方案完成之前,应使用屏障避孕。(坚强的⊕⊕)
医疗辅助生殖(MAR)服务人员应接种乙肝疫苗。(GPP)
正当理由
多项研究表明,HBV的性传播可能使水平和垂直传播的风险增加一倍。在怀孕期间和怀孕期间获得高效疫苗可以防止水平和垂直传播。
提供成功的疫苗接种过程,在无保护的性交过程中消除了HBV水平传播的风险。
在普通医疗机构工作的员工需要接种HBV疫苗,并制定完整的HBV疫苗接种计划。因此,MAR服务公司雇佣的员工应遵守相同的职业健康协议。
PICO问题:是否存在一个阈值,低于该阈值,乙型肝炎病毒的传播是不可能的?
根据
水平传输
没有研究报告血清乙型肝炎病毒(HBV)DNA载量阈值低于水平传播不会发生。
母婴传播(MTCT)
在孕前确定母亲病毒载量的出版物中,没有发现。
父婴传播(FTCT)
只有一项单一的回顾性研究,包括398对夫妇(自发怀孕,无精液处理),其中男性与未受感染的女性伴侣的HBV检测呈阳性。无论母亲的HBsAb水平如何,父亲血清中HBV DNA含量较低的婴儿之间的HBV垂直传播减少。当父亲血清HBV DNA<10²IU/ml时,未检测到HBV DNA。然而,在免疫原性反应和婴儿接种疫苗后,对脐带进行了检测(Cao等人,2016年)。
在HBV阴性女性和HBV阳性男性伴侣的情况下,没有证据表明HBV通过MAR垂直传播。
结论
根据目前的证据,在医疗辅助生殖的情况下,不可能确定治疗前HBV DNA载量阈值,低于该阈值垂直传播的可能性非常小。
正式建议
在开始任何MAR治疗之前,所有活动性或慢性HBV感染的患者必须经过传染病/肝脏专家的检查。(坚强的⊕)
开始对HBV阳性患者进行MAR治疗应由患者、伴侣、生育医生和传染病/肝脏专家共同决定。(坚强的⊕)
在女性HBV检测呈阳性的情况下,应讨论病毒垂直传播的可能性、怀孕期间疫苗接种的可用性和新生儿预防措施。(GPP)
正当理由
在考虑怀孕之前,咨询肝脏医生是一个重要的步骤,因为这可以评估伴侣双方以及未感染伴侣的预防性疫苗接种。
大多数研究HBV传播阈值的研究分析了孕期或分娩时的病毒载量,而不是孕前(治疗前)。任何感染HBV的母亲都有将病毒垂直传播给新生儿的风险(Liu等人,2015年,Lu等人,2017年,Sellier等人,2015年,Wiseman等人,2009年)。
因此,应该注意的是,母亲接种疫苗和新生儿免疫预防显著降低但不能消除HBV垂直传播的风险。
A3 辅助生殖技术及其对结果的影响
PICO问题:乙肝感染夫妇的MAR是否应优先使用IUI、IVF或ICSI?
没有研究能够比较不同医疗辅助生殖技术在妊娠率和垂直传播风险方面的有效性和安全性。
根据
一项前瞻性队列研究对125名乙型肝炎病毒(HBV)检测呈阳性的女性进行了IVF和ICSI比较。辅助生殖组共有176名儿童出生,145名通过体外受精出生,31名通过ICSI出生。当双胞胎为一对时,IVF儿童的HBsAg阳性率为5.9%(6/102),低于ICSI儿童的13%(3/23),尽管差异无统计学意义。当双胞胎被认为是两个时,HBsAg阳性体外受精儿童的比率与ICSI儿童相比没有差异(4.8%(7/145)与12.9%(4/31))。所有HBsAg阳性儿童均接受了乙型肝炎免疫球蛋白(HBIG)治疗,并在9-15个月大时血清转为阴性(Nie等人,2019年)。
结论
从水平和垂直传播的角度来看,目前没有足够的证据推荐一种技术(IUI/IVF/ICSI)优于另一种。
正式建议
不孕的原因应该决定在一方或双方HBV检测呈阳性的夫妇中用于MAR的特定技术(IUI/IVF/ICSI)。(坚强的⊕)
应告知HBV检测呈阳性的女性,MAR并不能消除垂直传播的风险。(GPP)
正当理由
只有接种HBV疫苗并保持可测量的抗体水平,才能保护妇女免受HBV感染,保护她的孩子免受垂直传播。在HBV检测呈阳性的女性中,HBV病毒DNA水平决定了垂直传播的风险。即使在婴儿预防的情况下,垂直传播的风险也不是零,但非常低(Boucheron等人,2021年)。
小问题:在卵母细胞/精子/胎盘中能检测到乙肝病毒DNA吗?
根据
精子中的DNA整合
在一项实验研究中,对9名HBV检测阳性男性的233次精子中期扩散进行了HBV DNA整合分析。只有一名患者的精子遗传物质中存在HBV DNA整合(Huang等人,2003年)。
卵母细胞/胚胎中的DNA整合
一项包括72对HBV血清不一致夫妇(31对男性HBsAg阳性,41对女性HBsAg阳性)的前瞻性队列研究调查了卵母细胞和胚胎HBsAg阳性与垂直传播风险之间的关系。12名婴儿出生于HBV阳性卵母细胞/胚胎夫妇:2名HBV DNA阳性卵母细胞/胚胎,7名HBV RNA阳性卵母细胞/胚胎,3名HBsAg阳性卵母细胞/胚胎。20名儿童抗-HBs检测呈阳性。6个月时,只有1名婴儿的抗-HBs、抗-HBc和抗-HBe血清呈阳性,然而,这名儿童在9个月时血清转化(Jin等人,2016)。
在Kong等人的研究中,使用50例妇科疾病和HBV阳性患者的卵巢组织来研究HBV在卵子中的表达和复制。在12%的卵巢组织样本中检测到HBcAg(6/50)。HBV DNA在卵巢组织的间质细胞、颗粒细胞和卵子中检测到,阳性率为14%(7/50)。三份样本HBV mRNA阳性(3%)。HBV mRNA阳性信号主要分布在卵母细胞和颗粒细胞的细胞质中。卵巢中可检测到HBV标志物的患者血清HBV DNA水平较高(Kong等人,2016年)。
在Hu等人的研究中,对来自HBV阳性夫妇的250个卵母细胞和578个未用于IVF-ICSI的胚胎进行了HBV存在和表达的分析。HBV DNA在9.6%的卵母细胞(24/250)和14.4%的胚胎(83/578)中被发现。在血清HBV DNA水平较高的女性中,发现卵母细胞和胚胎中的病毒阳性率显著增加(Hu等人,2011年)。
在Quint等人的一份报告中,用于体外受精胚胎培养的培养基被HBV感染血清污染。在体外受精期间暴露于HBV的母亲的任何子女中,PCR均无法证明HBV DNA(Quint等人,1994年)。
胎盘
Wei等人调查了155例HBsAg检测阳性妇女的胎盘,并报告通过免疫组织化学检测,胎盘HBsAg检测阳性率为37.42%(58/155)。此外,HBeAg检测阳性的母亲胎盘HBsAg阳性率较高(OR 2.00;95%可信区间1.02至3.95)。随着母体血液HBV DNA水平的增加,HBsAg阳性胎盘的风险更高(相对风险估计OR为3.24至3.85)(Wei等人,2015年)。
Chen等人研究了胎盘HBV感染在HBV向新生儿垂直传播中的作用。在此,他们从171名HBV检测呈阳性的孕妇身上采集了157份胎盘组织样本。胎盘HBsAg免疫组化阳性率为36.9%(58/157),HBcAg阳性率为31.8%(50/157)。通过RT-PCR和原位杂交(ISH)在42.7%的病例(67/157)中检测到HBV DNA,结果显示,HBV感染率在蜕膜细胞中为55.4%(87/157),在滋养层细胞中为51.0%(80/157),在绒毛间充质细胞中为46.5%(73/157),在绒毛毛细血管内皮细胞中为29.9%(47/157)(Chen等人,2013)。
在一项病例对照研究中,对101名HBsAg检测呈阳性的妇女的胎盘组织进行了调查。IHC和ISH显示,33.7%的胎盘样本(34/101)含有HBsAg,37.6%(38/101)含有HBxAg,20.8%(21/101)含有HBcAg,44.6%的胎盘样本(45/101)含有HBVDNA。此外,从母体一侧到胎儿一侧,HBV感染率逐渐降低(Xu等人,2002年)。
结论
HBV可在精子细胞、卵母细胞、颗粒细胞和胚胎中检测到。这相当于HBV垂直传播的理论风险,有待证实。
PICO问题:乙肝病毒和/或在MAR前治疗乙肝病毒是否会影响MAR的结果?
男性感染
根据
男性感染
一项回顾性队列研究,包括66对乙型肝炎(HBV)血清不一致夫妇和68名对照组,比较了IVF-ICSI周期的结果,并报告了HBV血清不一致夫妇和对照组在植入率(34.5%(20/58)和25.3(25/99))、每周期妊娠率(25.8%(17/66)和30.9%(21/68))方面没有显著差异,每个周期的流产率(17.6%(3/17)对33.3%(7/21))或每个周期的活产率(21.2%(14/66)对19.1%(13/68))(Cito等人,2019年)。
一项回顾性队列研究包括92对活动性HBV感染(HBV DNA+)的血清不一致夫妇、125对恢复期感染(HBsAg+、HBeAb+、HBcAb+、HBV DNA阴性)的血清不一致夫妇和121对血清阴性对照。在使用射精的夫妇中,活动期或恢复期HBV感染的夫妇或对照组的植入率(28.3%(45/159)对32.8%(39/122)对23.0%(38/165)),临床妊娠率(44.2%(34/77)对50.8%(30/59)对38.5%(30/78))没有显著差异,早期流产率(8.8%(3/34)对0%(0/30)对6.7%(2/30))或活产率(36.4%(28/77)对49.2%(29/59)对35.9%(28/78))。在使用手术取出精子的夫妇中,恢复期HBV感染夫妇的早期流产率明显高于活动期HBV感染夫妇和对照组(0%对23.1%(3/13)对5.0%(1/20))。然而,活动期和恢复期HBV感染夫妇与对照夫妇在植入率(31.1%(28/90)对26.1%(18/69)对25.3%(24/95))、临床妊娠率(50%(22/44)对39.4%(13/33)对42.6%(20/47))或活产率(50%(22/44)对27.3%(9/33)对36.2%(17/47))方面没有显著差异(郑等人,2016)。
一项回顾性队列研究包括136名HBsAg检测呈阳性的男性和426名HBV血清阴性的对照组,报告两组之间的植入率(38.5%(104/270)对37.7%(206/547))或临床妊娠率(58.1%(79/136)对53.7%(146/272))无显著差异(Shi等人,2014)。
一项包括32名HBsAg检测呈阳性的男性和64名对照的配对病例对照研究报告,两组之间的植入率(13.5%对20.0%)、每个周期的临床妊娠率(18.8%(6/32)对31.3%(20/64))或每个周期的活产率(15.6%(5/32)对23.4%(15/64))(Oger等人,2011年)。
一项包括916名HBV检测阳性患者(457名HBsAg和459名HBsAg阴性)的回顾性队列研究比较了1824个IVF-ICSI周期的生殖结果,并报告了HBV阳性和阴性男性在IVF后的生殖结果在植入率(24.9%(284/1140)与26.7%(296/1108))或临床妊娠率(40.5%(217/535)与40.3%)方面没有显著差异(210/521)). 然而,与对照组相比,HBV阳性男性的ICSI植入率(18.3%(126/688)比24.2%(159/657))和临床妊娠率(31.2%(96/308)比39.3%(118/300))显著降低(Zhou等人,2011年)。
一项分析HBV血清不一致夫妇(n=161)IVF-ICSI生殖结局的回顾性队列研究报告,血清阳性和血清阴性男性在每个开始周期的持续妊娠率上没有显著差异(30.4%对29.9%)(Lee等人,2010年)。
女性感染
一项回顾性队列研究调查了HBsAg+/HBeAg+女性(n=180)、HBsAg+/HBeAg-女性(n=714)和血清阴性对照组(7565)的IVF-ICSI生殖结局。HBsAg+/HBeAg-女性的植入率显著低于对照组(35.7%(607/1701)vs.38.7%(6950/17939)),但HBsAg+/HBeAg+女性的植入率不低于对照组(39.6%(158/399)vs.38.7%(6950/17939))。在HBsAg+/HBeAg+女性、HBsAg+/HBeAg女性和对照组之间,临床妊娠率(61.7%(111/180)对57.6%(411/714)对60.4%(4628/7656))、流产率(11.7%(13/111)对10.0(41/411)对11.7%(541/4628))或活产率(53.1%(93/175)对51.1%(360/704)对52.3%(3911/7480))(王等人,2019年)。
一项回顾性病例对照研究比较了慢性HBV血清不一致夫妇(n=123个周期)和匹配的HBV阴性夫妇(246个周期)的IVF-ICSI周期结果,结果显示慢性HBV感染夫妇和匹配的HBV阴性对照组的植入率(30.52%(76/249)与28.34%(142/501))无显著差异,临床妊娠率(44.72%(55/123)对43.09%(106/246))或活产率(42.28%(52/123)对40.65%(100/246))(Chen等人,2014年)。
一项回顾性队列研究包括136名HBsAg检测呈阳性的男性和426名HBV血清阴性的对照组,报告两组之间的植入率(36.0%(54/150)对38.5%(117/304))或临床妊娠率(48.1%(37/77)对50.6%(78/154))无显著差异(Shi等人,2014年)。
一项分析HBV血清不一致(n=131)夫妇IVF-ICSI生殖结局的回顾性队列研究报告,血清阳性和血清阴性妇女在每个开始周期的持续妊娠率上没有显著差异(26.7%对30.2%)(Lee等人,2010年)。
结论
现有证据无法阐明男性HBV感染是否会影响MAR的结果。多项研究表明,当比较血清阴性和HBV血清阳性的女性时,MAR后的生殖结果没有差异。
A4 预防/减少辅助生殖期间的传播
PICO问题:在MAR期间,哪些技术可用于预防/减少乙型肝炎传播?
接种疫苗
根据
无法检索到比较接种乙型肝炎病毒(HBV)阳性男性的女性伴侣与未接种的研究。
正式建议
HBV阳性个体的伴侣应接种疫苗。(坚强的⊕)
正当理由
高效HBV疫苗的可用性可以防止水平和垂直传播。
精液处理
根据
一项包括4名乙肝病毒(HBV)检测呈阳性的男性精子样本在内的初步实验假设,一种特定的ICSI制备技术(向上游动)可以用于分离不含HBV DNA的精子,以便对慢性HBV感染的男性进行ICSI。在含有不活动或进行性精子的部分中未检测到HBV DNA。在一个非进行性精子组分中,发现了HBV DNA,但它不可量化(<15 IU/L)(Condijts等人,2020年)。
正式建议
应告知HBV检测呈阳性的男性,目前的精液制备技术无法选择用于MAR的HBV无DNA精子。(GPP)
当对HBV检测阳性的男性进行MAR时,应根据ESHRE体外受精实验室良好实践指南进行常规精液处理。(GPP)
正当理由
Condijts的研究是一项试点研究,需要进一步确认(Condijts等人,2020年)。目前还没有能够选择无HBV DNA精子的精液处理技术。
关于精液处理的任何进一步问题将不予讨论。
PICO问题:血浆病毒载量与精液中乙肝病毒检测相关吗?
根据
四项回顾性研究,包括211名HBsAg+患者,表明精液中可以观察到HBV DNA(Ayoola等人,1981年,Fei等人,2015年,Hadchouel等人,1985年,Qian等人,2005年),与血清相比,精液中的HBV DNA滴度更低(Hadchouel等人,1985年,Qian等人,2005年)。肝炎血清学状态可能与精液中的HBV相关,血清HBV DNA和HBeAg的组合是识别精液HBV DNA阳性男性的最佳预测因子(Fei等,2015)。
正式建议
根据目前的证据,不建议对精液或精子进行HBV DNA检测。(强)⊕)
正当理由
这表明,并非所有慢性HBV感染男性的精子中都含有HBV DNA,而且与血清相比,精子中的HBV DNA滴度更低。考虑到HBV阳性男性的所有女性伴侣都应在MAR前接种,因此无需测量精液中的HBV DNA
A5 减少/避免垂直传播
PICO问题:哪些干预措施可用于减少/避免乙型肝炎病毒向新生儿的垂直传播?
选择性剖腹产
根据
一项系统回顾和荟萃分析调查了剖宫产(CS)和阴道分娩(VD)后乙型肝炎病毒(HBV)的母婴传播率。在出生时进行评估时,7.2%(151/1940)的新生儿在CS后检测出HBV血清学阳性,而阴道分娩后为16.6%(301/1813)(OR 0.269;95%可信区间0.139至0.520;7项研究;3904对母婴)。当在6个月大时进行评估时,两组之间的差异不再存在,3.3%(132/4022)婴儿在CS后检测出HBV血清学阳性,而阴道分娩后的HBV血清学阳性率为4.1%(145/3520)(OR 0.790;95%CI 0.614至1.016;13项研究;7542对母婴)(Chen等人,2019年)。
一项前瞻性队列研究包括1384名HBV检测呈阳性的孕妇,比较了867例CS和517例阴道分娩,并报告CS组和阴道分娩组之间HBV DNA检测呈阳性的新生儿比例没有显著差异(分别为0.7%和1.7%)。然而,随访后,CS组有0.6%的婴儿(5/888)被确定患有慢性乙型肝炎感染,而阴道分娩组有1.7%的婴儿(9/519)被确定患有慢性乙型肝炎感染(Peng等人,2018年)。
一项前瞻性队列研究比较了经阴道分娩或CS后HBV向婴儿的传播率。所有婴儿均接种了乙肝疫苗,239/447婴儿也接种了乙肝免疫球蛋白(HBIG)。单独接种HBV疫苗的婴儿无论是通过CS还是阴道分娩,其HBV感染率都相似。然而,在出生时接受HBV疫苗和HBIG的婴儿中,CS分娩的婴儿(3/53)的HBV感染率显著低于阴道分娩的婴儿(57/286)(Lee等人,1988)。
正式建议
仅基于母亲HBV阳性,不建议剖腹产。(强)⊕⊕ )
正当理由
没有证据表明剖腹产后HBV母婴传播的风险低于阴道分娩后。
母乳喂养
根据
一项系统回顾和荟萃分析调查了喂养方式对HBV垂直传播的影响,发现母乳喂养不会增加婴儿感染HBV的风险(风险差异-0.8%,95%可信区间-1.6%至0.1%,32项研究,5650名婴儿)(郑等人,2011年)。
在Azzari等人的研究中,对所有受试女性的母乳样本进行了HBV标记物检测,并报告所有样本的HBsAg、抗HBcAg和抗HBeAg检测均呈阳性。然而,所有样本的HBeAg和HBV DNA检测均为阴性。没有关于纳入婴儿血清转化的数据报告(Azzari等人,1990年)。
Zhang等人的一项大型队列研究,包括1186名HBsAg检测呈阳性的母亲及其婴儿,根据母乳喂养或奶瓶喂养调查了婴儿的HBV标志物。在HBeAg检测呈阴性的母亲中,无论接受何种免疫接种,所有婴儿均未感染HBV。在HBeAg检测呈阳性母亲的配方奶粉喂养婴儿中,无论他们只接种疫苗还是接种HBIG,HBV感染率没有差异。在HBeAg检测呈阳性母亲的母乳喂养婴儿中,仅接种疫苗组(7/26,26.9%)和接种HBIG组(4/106,3.8%)之间的HBV传播率存在显著差异(Zhang等人,2014a)。
一项回顾性队列研究,包括544名HBsAg检测呈阳性的母亲及其546名婴儿,调查了喂养方式对HBV向婴儿传播的影响。慢性HBV感染分别发生在母乳喂养儿童的1.5%(6/397)和配方奶粉喂养儿童的4.7%(7/149)。在对母亲HBeAg状态等混杂因素进行校正后,母乳喂养与婴儿的慢性HBV感染(校正OR 0.99,95%可信区间0.28至3.58)或自我解决感染(校正OR 0.57,95%可信区间0.20至1.65)无关(Chen等人,2013年)。
正式建议
在HBV检测呈阳性的女性中,母乳喂养可能不是禁忌。(有条件的 ⊕⊕ )
正当理由
母乳喂养与HBV母婴传播风险之间没有关联。母乳喂养对健康有很大好处。
该建议得到了欧洲肝脏研究协会(EASL)指南的支持(Lampertico等人,2017年)。
接种疫苗
根据
一项系统回顾和荟萃分析调查了疫苗预防HBV母婴传播的效果。对于HBsAg检测呈阳性母亲的婴儿(包括接受和未接受乙肝免疫球蛋白(HBIG)的婴儿),疫苗效力范围为79%至98%(7项研究)。所有研究(包括HBsAg阳性和HBsAg阴性母亲)的血清保护比例中值为98%(范围为52%至100%)(Schillie和Murphy,2013)。
一项更古老的系统性综述和荟萃分析也调查了接种疫苗预防婴儿HBV感染的有效性,结果表明,与安慰剂或不干预相比,接种疫苗显著降低了乙型肝炎发生的风险(RR 0.28,95%可信区间0.20至0.40,4项研究)(Lee等人,2006年)。
在一项随机对照试验中,包括238名HBsAg检测呈阳性的女性,对早期接种(出生后2天内,1个月和2个月)与延迟接种(3个月、4个月和5个月)进行了比较。三个月大的新生儿中没有一例HBsAg检测呈阳性。早期接种计划的2名婴儿出现亚临床HBV感染。此外,在11个月和24个月大时,延迟接种计划的抗HB浓度显著较高(Schalm等人,1989年)。
在一项大型前瞻性队列研究中,包括863名HBsAg检测呈阳性的母亲及其相应的871名婴儿,对两种剂量的HBV疫苗进行了比较。与低剂量疫苗的5.2%(16/306)相比,高剂量疫苗(0/565)未观察到免疫预防失败。所有血清转化婴儿均为HBeAg检测呈阳性且病毒载量超过4x107IU/ml的母亲所生(Wang等人,2016)。
在一项前瞻性队列研究中,包括HBsAg检测呈阳性的母亲,比较了6种不同的预防措施。多年来,所有组中高抗-HBslevel的比例逐渐下降。与方案A(0、1、6个月)(30.9%)或方案C(0、1、2个月)(30.7%)相比,方案B(2、3、8个月)的HB抗体水平显著升高(45.6%)。此外,方案B的使用在2岁后提供了更高的抗HBc血清转化保护(Young等人,2003年)。
一项小型队列研究包括81名来自无症状HBsAg携带者母亲的儿童,比较了仅接种疫苗与联合接种HBIG的情况。5年后,接种疫苗的婴儿的HB抗体滴度与仅接种HBIG和HBIG的婴儿之间未观察到统计学差异(Gonzalez等人,1993年)。
正式建议
所有HBV阳性夫妇出生的新生儿都应该接种疫苗。(强 ⊕⊕⊕)
正当理由
目前的证据表明,乙型肝炎病毒的围产期传播是大多数慢性乙型肝炎病毒感染病例的原因,可以通过接种疫苗来预防。该建议得到了欧洲肝脏研究协会(EASL)指南的支持(Lampertico等人,2017年)。
乙型肝炎免疫球蛋白(HBIG)
根据
一项系统回顾和荟萃分析比较了在怀孕期间注射乙肝疫苗和乙肝免疫球蛋白(HBIG)的新生儿与注射乙肝疫苗和母亲HBIG的婴儿。比较这两组新生儿HBsAg感染率的meta-RR在出生时为0.66(95%可信区间0.52至0.84;7项随机对照试验;1061名婴儿),7-12个月时为0.54(95%可信区间0.42至0.69;12项随机对照试验;1453名婴儿),12个月后为0.54(95%可信区间0.42至0.69;7项随机对照试验;1214名婴儿)。接受疫苗接种和HBIG的新生儿在出生时(RR 2.12;95%可信区间1.66至2.70;4次随机对照试验;291名婴儿)和7-12个月大时(RR 1.12;95%可信区间1.03至1.22;8次随机对照试验;566名婴儿)的保护性抗体水平较高,但在12个月大后(RR 1.06;95%可信区间0.96至1.16;5次随机对照试验)(Jin等人,2014年)。
另一项系统性综述和荟萃分析比较了HBsAg+/HBeAg-母亲的婴儿仅接种HBV疫苗与HBV疫苗和HBIG,并报告血清保护率无差异(OR 1.24;95%可信区间0.97至1.58;4项研究;1323名患者)(Machaira等人,2015年)。
一项随机对照试验,包括202名HBsAg检测呈阳性的母亲所生的婴儿,比较了出生时一剂HBIG与三剂(出生时,3个月和6个月)安慰剂或生理盐水。除安慰剂组的2名婴儿外,安慰剂组的所有婴儿在3个月大时均检测出HBsAg阳性,相比之下,接受一剂HBIG组的HBsAg阳性率为50%,三剂方案组的HBsAg阳性率为23%(Beasley等人,1981年)。
在一项前瞻性队列研究中,包括HBsAg检测呈阳性的母亲,对两种剂量的HBIG(100和200 IU)进行了比较。所有婴儿也接种了3剂疫苗。7个月时,围产期感染婴儿的数量没有显著差异(1.5%(8/545)与1.9%(12/632))(Wei等人,2018年)。
一项前瞻性队列研究,包括90名HBsAg检测呈阳性的女性及其婴儿,比较了3种HBIG方案。在第一组中,婴儿只接受疫苗接种。在第二组中,婴儿在出生后2小时内接受疫苗接种和HBIG剂量。在第三组中,母亲在怀孕期间接受3剂HBIG,婴儿接种疫苗并接受出生剂量的HBIG。HBs抗体检测呈阳性的婴儿数量分别为24/30、27/30和29/30(龚和刘,2018)。
一项前瞻性队列研究,包括1150名HBsAg检测呈阳性的女性,将仅接种疫苗与接种疫苗加HBIG用于婴儿免疫预防进行了比较,并报告仅接种疫苗组的免疫预防失败率显著高于接种疫苗加HBIG组(RR 0.371,95%可信区间0.167至0.825)(Zhang等人,2014b)。
一项前瞻性队列研究,包括324名HBsAg检测呈阳性的女性,比较了母亲的HBIG与婴儿的HBIG,母亲和婴儿均为HBIG,母亲或婴儿均为无HBIG。与无HBIG组相比,母亲和婴儿组的HBIG阳性率最低(OR 0.14;95%可信区间0.02至0.90),而婴儿组的HBIG阳性率最低(OR 0.07;95%可信区间0.02至0.23)。无HBIG组的HBsAg阳性率为14.3%(郭等人,2012年)。
一项大型前瞻性队列研究,包括1010名HBsAg检测呈阳性的女性所生的婴儿,比较了仅接种疫苗(4剂)和接种疫苗加出生剂量HBIG。出生时接受过HBIG的婴儿在1个月和2个月大时的抗体滴度显著较高。然而,在6、9和18个月大时,两组之间的抗体滴度没有统计学上的显著差异(Wheeley等人,1991年)。
一项前瞻性队列研究,包括HB s-和e-抗原检测呈阳性的女性婴儿,比较了3种预防方案。第一组在出生时和3个月大时接受了一定剂量的HBIG,此时开始接种疫苗。第二组在出生时接受HBIG,并在4-7天开始接种。第三组在出生时也接种了HBIG,但在1个月大时开始接种。9/159(5.7%)接受任何HBIG疫苗方案治疗的婴儿成为慢性HBsAg携带者,其中4名在疫苗接种开始前已呈阳性。三种预防方案中的婴儿HBsAg携带率分别为2.0%、6.0%和8.6%;这些差异在统计学上并不显著(Beasley等人,1983年)。
一项回顾性队列研究,包括298名HBsAg检测呈阳性的母亲及其婴儿,报告11名婴儿(3.7%)HBsAg检测呈阳性,16名婴儿(5.4%)HBsAg检测呈阴性,但抗-HBc检测呈阳性,表明过去感染已解决。在11名感染HBV的儿童中,只有一名及时接种HBIG和乙肝疫苗,另有10名儿童未接种HBIG或接种乙肝延迟疫苗。在16名感染已解决的儿童中,9名未接种HBIG,1名在出生40天后接种了第一剂疫苗(Hu等人,2012年)
一项横断面研究,包括4112名HBsAg检测呈阳性的女性及其婴儿,报告称,对于出生后12-24小时内接种出生剂量HBV疫苗的婴儿,调整后的HBV传播几率比出生后12小时内接种的婴儿高1.9倍(2.4%对0.6%;调整后OR 2.9;95%CI 1.4至6.3)。此外,他们报告HBV传播与HBIG给药之间没有显著关联(Joi等人,2019年)。
正式建议
对于HBV检测呈阳性的母亲所生的儿童,建议在接种疫苗的同时服用乙肝免疫球蛋白(HBIG)。(强)⊕⊕)
HBIG管理部门应遵循当地或国家指南。(GPP)
正当理由
HBIG提供被动获得的抗HBs和临时保护。HBIG可以增强保护,直到对疫苗接种产生反应。
免疫实践咨询委员会(ACIP)建议在HBV感染妇女出生后12小时内为其出生的婴儿接种乙肝疫苗和乙肝免疫球蛋白(HBIG),然后完成疫苗系列和疫苗接种后血清学检测(Schillie等人,2018年)。此外,该建议得到了欧洲肝脏研究协会(EASL)指南的支持(Lampertico等人,2017年)
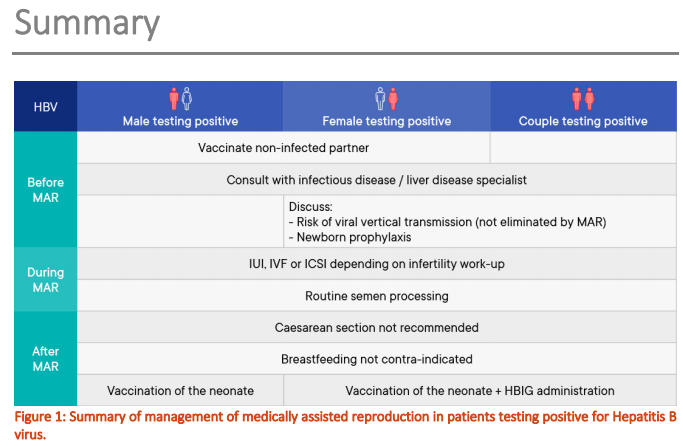
B部分:丙型肝炎病毒
B1 流行率和检测
叙述性问题:丙型肝炎病毒的流行率是多少?
2015年,7100万人患有慢性丙型肝炎病毒(HCV),全球疫情不均衡,各国之间和各国内部存在差异(世卫组织,2017年)。东地中海地区报告的HCV RNA阳性人数最高(±1500万),其次是西太平洋地区和欧洲地区(均为±1400万),东南亚地区和非洲地区(均为±1000万),以及美洲地区报告的HCV RNA阳性人数最低(±800万)。
2015年全球丙型肝炎病毒感染总体流行率为1%,东地中海地区的估计流行率最高(2.3%),其次是欧洲地区(1.5%)、非洲地区(1.0%)、美洲和西太平洋地区(均为0.7%)和东南亚地区,估计流行率最低(0.5%)。
在欧盟和经济区国家,2015年的总体HCV流行率估计为1.1%(95%可信区间0.9-1.4),相当于560万例抗-HCV阳性病例。大多数国家抗-HCV的估计患病率<1%。西班牙、斯洛伐克、希腊、拉脱维亚、罗马尼亚和意大利的抗-HCV感染率估计分别为1.1%、2.0%、2.2%、2.4%、3.2%和5.9%(Hofstraat et al.,2017)。在中欧地区,估计的抗-HCV阳性流行率在0.2%和2.1%之间(Urbanek等人,2016年),估计的HCV RNA阳性流行率在0.2%和3.5%之间(Madalinski等人,2015年)。
在过去几年中,全球丙型肝炎患病率的估计值似乎有所下降(Cornberg等人,2011年,Lanini等人,2016年,世卫组织,2017年)。
不安全的医疗保健做法和注射吸毒仍然是主要的传播方式。在高收入国家,慢性丙型肝炎的患病率通常低于2%。然而,由于高风险人群的规模不同,社会经济条件相似的国家内部存在差异。患病率最高(>5%)的国家主要是中低收入国家,包括埃及、加蓬、乌兹别克斯坦、喀麦隆、蒙古、巴基斯坦、尼日利亚、格鲁吉亚(拉尼尼等人,2016年)。
叙述性问题:如何在医疗辅助生殖之前进行丙型肝炎状态检测?
丙型肝炎病毒(HCV)感染的病毒学标志物是抗HCV抗体、HCV核心抗原、HCV RNA和HCV基因型(Pawlotsky,2002)
HCV筛查是基于检测HCV总抗体(IgM和IgG)。酶免疫分析法(EIA)和化学发光免疫分析法(CIA)最常用于检测血清中的抗HCV抗体。全血或血浆也符合条件。随着时间的推移,血清学检测不断发展,产生了几代EIA。抗-HCV检测仍有缺点(例如,感染后检测窗口延长,阳性预测值低),因此确认检测被广泛使用(Cobb等人,2014年,Saludes等人,2014年,Uliana等人,2014年)。
近年来,与传统的EIA相比,快速诊断试验(RDT)能够以更低的成本筛查HCV抗体(Chevaliez和Pawlotsky,2018年,Smith等人,2012年)。
不同丙型肝炎病毒抗体检测的表现各不相同(Khuroo等人,2015年,Tang等人,2017年)。
对于EIA检测呈阳性的个体,可使用重组免疫印迹分析(RIBA)进行确认性抗体检测。RIBA的一个主要问题是中间结果的出现(Ponde,2013)。HCV感染和循环病毒基因组的确认基于HCV RNA的检测。核酸技术(NAT)是金标准,最常用于确认试验(Benjamin,2001,Sarrazin,2002,Stramer,2002)。
聚合酶链反应(PCR),尤其是实时PCR,与NAT最相关(Carithers等人,2000年,Colucci,2012年,Gullett和Nolte,2015年,Irshad等人,2016年,Kessler和Stelzl,2017年,Krajden,2000年,Pawlotsky,2003年,Schutten,2008年,Scott和Gretch,2007年,Singh等人,2017年)。PCR领域的新技术包括数字滴PCR、下一代测序、芯片实验室、数字抗原分析(Roth,2019)。
或者,转录介导扩增(TMA)和分支DNA分析可用于检测HCV RNA(Al Olaby和Azzazy,2011年,Albertoni等人,2014年)。
HCV核心抗原可作为HCV复制的间接标记物,检测有可能取代NAT(Freiman等人,2016年)。与PCR相比,它们具有成本降低的优势,并且可以在与一些EIA分析相同的诊断平台上进行。
HCV基因分型可通过抗体检测和PCR技术进行,但仅在HCV治疗中必不可少(Al Olaby and Azzazy,2011,Podzorski,2002,Wilson等人,2017,Yang and Wei,2018)。
结论
根据欧洲组织和细胞指令,丙型肝炎病毒检测是强制性的,作为一种预防措施,以降低传播给伴侣和后代的风险。
B2 在医疗辅助生殖之前预防传播
小问题:通过阴道/肛交传播丙型肝炎病毒的风险是什么?
根据
一项系统性综述包括38项研究,其中9项针对非血液透析、非肾移植患者性接触者的对照研究和29项非对照研究,共有4250名稳定的异性性接触者报告573/4250抗HCV抗体检测呈阳性。计算得出的配偶合并患病率为13.48%(95%可信区间12.48至14.55)。在9项对照研究中,非HCV流行地区抗-HCV阳性患者的配偶的抗-HCV患病率显著高于阴性对照的配偶(15.2%对0.9%,或20.57,95%可信区间6.05至84.08)。两项研究报告了HCV感染男性的女性接触者和女性感染者的男性接触者中抗HCV的患病率。只有在男性接触HCV感染女性的人群中,HCV感染率显著高于对照组(OR 2.14,95%可信区间1.12至4.08)(Ackerman等人,1998年)。
一项横断面研究招募了500名长期感染HCV的异性恋、一夫一妻制患者≥ 36个月和他们的伙伴≥ 前6个月内有3次性接触。20/500(4.0%)的伴侣检测出抗-HCV阳性,其中13/20(65.0%)检测出HCV PCR阳性。(9/20(45.0%)一致,8/20(40.0%)不一致,3/20(15.0%)不确定)。可能归因于性接触的患病率为3/500(0.6%;95%可信区间0.0%至1.3%),因此,根据3对确诊夫妇和3对未知夫妇的估计发病率至少为3.6/10000人年(95%可信区间0.0至7.7),最大为7.2/10000人年(95%可信区间1.3至13.0)。每个性行为的估计风险最低为1/380000(95%可信区间1/600000至1/280000),最高为1/190000(95%可信区间1/130万至1/100000)(Terrault等人,2013年)。
60例HCV PCR阳性患者的病例对照研究。两名配偶(3.39%)抗-HCV阳性,一名配偶HCV-PCR阳性。两名阳性配偶与指数患者的关系持续时间>15年(Hajani等人,2006年)。
对53例血液透析患者(其中16例抗-HCV和HCV-PCR均阳性)进行横断面研究。配偶中没有一人抗-HCV阳性(0/16)(Fadil-Romao等人,2006年)。
一个研究组对600名慢性感染HCV患者(320名男性+280名女性)及其伴侣进行了回顾性队列分析,并对这些慢性感染HCV患者的216名抗-HCV阴性伴侣进行了前瞻性队列分析。在回顾性队列研究中,12/600(2%)的伴侣(4/280女性和8/320男性)抗-HCV阳性,11/600(1.8%)HCV RNA阳性。所有11对夫妇均一致感染同一基因型(1b型)。性交率为1.73/周。在前瞻性队列分析中,性交率为1.9/周。没有伴侣抗-HCV阳性(Tahan等人,2005年)。
对112名抗-HCV和HCV RNA阳性患者(75名男性和37名女性)及其抗-HCV阴性配偶进行前瞻性队列分析。20个月后发生一次血清转化(一名女性伴侣,基因型1b),导致传播风险为2.33/1000人年(Kao等人,2000年)。
在一项针对585名抗-HCV和HCV RNA阳性患者及其455名配偶的横断面研究中,配偶中的HCV患病率为71/455(15.6%)。在受感染的患者中,19.8%的患者关系>20年,而8%的患者关系<20年(或2.8,95%可信区间1.5至5.3)(Caporaso等人,1998年)。
一项横断面研究分析了121例慢性肝病患者(抗-HCV阳性,116例HCV-PCR阳性)及其配偶。21/121(17.4%)配偶抗-HCV阳性,其中19例HCV-PCR阳性。19对夫妇中有12对(63.2%)基因型一致(Koda等人,1996年)。
对68例抗-HCV和HCV-PCR阳性慢性肝炎患者及其伴侣进行的横断面研究显示,68例配偶中有4例(5.9%)抗-HCV阳性,其中2例为HCV-PCR阳性(一致性1型)。HCV阳性和HCV阴性配偶的关系持续时间分别为25年(15-30年)和10年(2-43年)(Tong等人,1995年)。
在895名抗-HCV和HCV-PCR阳性的异性恋患者及其抗-HCV阴性伴侣中进行的前瞻性队列分析显示,平均性交频率为1.8/周(无肛交,无安全套使用)。三对配偶的HCV血清转化率(2例1b和2a基因型一致,1例不一致(试验前进行了牙齿植入),导致传播率为0.37/1000人年。和谐夫妇的传播率为0.25/1000人年(Vandelli等人,2004年)。
正式建议
在超过12个月的一夫一妻制异性关系中,没有迹象表明在血清不一致的感染夫妇中使用屏障避孕药来降低丙型肝炎病毒(HCV)传播的风险。(有条件的 ⊕⊕ )
正当理由
提交的大型前瞻性研究表明,性伴侣之间的传播非常低。HCV的主要传播途径是肠外传播,而不是在没有性病或HIV或肝脏病理学等医学共病的情况下进行性交。性传播HCV的风险与伴侣数量之间存在相关性。
只有一项研究详细报道了性交行为,并显示在阴道性交和肛交之间HCV传播没有显著差异。
PICO问题:是否存在一个治疗前(三月前)阈值,低于该阈值,丙型肝炎病毒不太可能传播?
根据
水平传输
我们没有发现报告丙型肝炎病毒(HCV)RNA血清阈值低于水平传播不会发生的研究。
垂直传播
在怀孕前测量孕妇HCV病毒载量的文献中没有发现。
正式建议
在开始任何医疗辅助生殖治疗(MAR)之前,所有活动性或慢性HCV感染的患者必须经过传染病/肝脏专家的检查。(GPP)
开始对HCV阳性患者进行MAR治疗应由患者、伴侣、生育医生和传染病/肝脏专家共同决定。(坚强的⊕)
如果女性HCV检测呈阳性,应在MAR治疗前讨论病毒垂直传播的可能性。(GPP)
正当理由
所有已确定的研究都集中于测量怀孕期间的HCV-RNA病毒载量,因此没有足够的证据表明MAR前病毒血症的特定临界点,以避免垂直传播和HCV感染后代。
随着血液制品筛查的实施,垂直传播作为儿童HCV的主要传播途径变得越来越重要。HCV阳性/HIV阴性女性的HCV垂直传播估计值在1.1到10.7%之间(Benova等人,2014年)。垂直HCV感染的合并风险为5-8%。
评估孕前HCV-RNA病毒载量与垂直传播之间相关性的临床队列研究需要找到一个阈值,超过该阈值新生儿感染的可能性更大。
B3 辅助生殖技术及其对结果的影响
PICO问题:丙型肝炎感染夫妇的MAR是否应优先使用IUI、IVF或ICSI?
根据
在一项前瞻性队列研究中,35对患有病毒血症和慢性丙型肝炎病毒(HCV)感染的男性伴侣在精液处理(梯度离心和向上游动)后接受了卵巢刺激和IUI(n=14)或ICSI(n=21)。IUI或ICSI后没有出现水平或垂直传播的病例(Savasi等人,2013年)。
一项横断面观察研究包括60名HCV检测呈阳性的女性(30名HCV+RNA-和30名HCV+RNA+女性)调查了ICSI后垂直传播的风险。RNA阳性的女性没有垂直传播,但是,一名HCV+RNA+女性所生的婴儿HCV检测呈阳性(Nesrine和Saleh,2012年)。
一项前瞻性队列研究,包括40对HCV血清不一致的夫妇(男性HCV阳性),报告了这些夫妇的ICSI治疗结果。这些女性伴侣中没有一个发生了血清学改变(Garrido等人,2004年)。
结论
从水平和垂直传播的角度来看,目前没有足够的证据推荐一种技术(IUI/IVF/ICSI)治疗丙型肝炎患者。
正式建议
不孕的原因应决定一方或双方检测HCV阳性的夫妇MAR的具体技术(IUI/IVF/ICSI)。(强)⊕)
应告知HCV检测呈阳性的女性,MAR并不能消除垂直传播的风险。(GPP)
小问题:丙型肝炎病毒RNA能在卵母细胞/精子/胎盘中检测到吗?
根据
精子中的RNA
目前还没有关于精子中HCV整合的研究。
卵母细胞中的RNA
Papaxanthos-Roche等人的实验研究调查了辅助生殖技术期间丙型肝炎病毒(HCV)RNA阳性妇女的人类卵母细胞对HCV污染的易感性(Papaxanthos-Roche等人,2004)。在17/24未受精卵母细胞、6/7尝试ICSI后的卵母细胞和11/17尝试常规IVF后的卵母细胞中检测到HCV RNA。在19/20(95%)卵泡液样本中发现HCV RNA。血浆和卵泡液HCV RNA负荷之间的相关性较弱(Papaxanthos-Roche等人,2004年)。
胎盘
一项实验研究报告,来自妊娠早期和中期的原代人类滋养层细胞和绒毛外滋养层细胞系(HTR8)表达与HCV结合/进入相关的受体,并允许HCV摄取(Giugliano et al.,2015)。
结论
不能排除卵母细胞中存在丙型肝炎病毒RNA的可能性。然而,通过使用生殖材料传播丙型肝炎的风险仍有待证实。
PICO问题:丙型肝炎病毒和/或在MAR前治疗丙型肝炎病毒是否会影响MAR的结果?
男性感染
根据
文献检索中没有评价MAR前抗病毒治疗对生殖结局影响的文章。
一项回顾性队列研究包括60对血清不一致的丙型肝炎病毒(HCV)夫妇和69对未感染的夫妇,调查了ICSI的生殖结局。与对照组相比,HCV不和谐夫妇的受精率显著降低(61%对75%)。然而,在每个周期的妊娠率(17.6%(18/102)对20.2%(14/69))、每个周期的流产率(11.1%(2/18)对28.5%(4/14))、或每个周期的活产率(15.7%(16/102)对15.9%(11/69))(Cito等人,2019年)方面没有统计学差异。
一项包括78对HCV血清不一致夫妇和1256对未感染夫妇的回顾性队列研究调查了体外受精的生殖结局。HCV不和谐夫妇与对照组在受精率(80.99±19.95 vs.78.14±19.73)、临床妊娠率(48.6%(36/74)vs.55.0%(691/1256))或流产率(18.9%(14/74)vs.19.0%(239/1256))(Yang等人,2015年)方面没有统计学差异。
一项前瞻性病例对照研究包括28对HCV血清不一致夫妇和46名未感染对照,比较了IVF-ICSI的生殖结局。与对照组相比,HCV血清不一致夫妇的受精率显著降低(54.7%对68.2%)。然而,HCV血清不一致的夫妇和对照组在植入率(12.8%对4.2%)、每次胚胎移植的临床妊娠率(17.5%对7.0%)或出生的孩子数量(8/28对2/46)方面没有统计学差异(Prisant等人,2010年)。
另一项回顾性队列研究包括12对HCV血清不一致(9名男性和3名女性HCV检测呈阳性)和27对未感染夫妇,调查了IVF-ICSI的生殖结局。HCV血清不一致夫妇和对照夫妇之间的受精率没有统计学差异(63.9%对75.9%),但是,每个周期的临床妊娠率有显著差异(0%(0/12)对41%(11/27))(Pirwany等人,2004年)。
结论
在评估男性HCV感染对不孕症治疗结果的影响时,有相互矛盾的结果。尽管据报道,HCV-RNA阳性男性夫妇的受精率显著降低,但其他研究报告,HCV感染不会影响这些夫妇的IVF-ICSI周期结果。
女性感染
根据
文献检索中没有评价MAR前抗病毒治疗对生殖结局影响的文章。
一项回顾性队列研究比较了25个血清不一致的丙型肝炎病毒(HCV)首次IVF-ICSI周期与25个匹配对照周期的临床结果。在HCV血清不一致的夫妇和对照组之间,受精率(67%对86%)和植入率(6%(3/47)对23%(11/47))在统计学上显著降低。然而,HCV血清不一致的夫妇和对照组在临床妊娠率(12%(3/25)对36%(9/25))、流产率(4%1/25对12%(3/25))或出生的孩子数量(2/25对7/25)方面没有统计学差异。17名确认存在活跃HCV复制的亚组患者也未出现植入(0%(0/22)对26%(6/23)),且活跃复制的HCV阳性患者未发生活产(Shaw Jackson等人,2017年)。
一项包括90对HCV血清不一致夫妇和1256对未感染夫妇的回顾性队列研究调查了体外受精的生殖结局。HCV血清不一致夫妇与对照组在受精率(76.93±19.18 vs.78.14±19.73)、临床妊娠率(45.6%(41/90)vs.55.0%(691/1256))或流产率(23.3%(21/90)vs.19.0%(239/1256))(Yang等,2015)方面没有统计学差异。
一项包括40名HCV RNA+、40名HCV RNA血清阳性和40名HCV PCR血清阴性女性的回顾性队列研究比较了ICSI的临床结果。与HCV PCR+和PCR-女性及对照组相比,取消的周期明显增多(52%对30%对5%),受精率降低(28%对32%对67%)。此外,与HCV-PCR-和对照组相比,HCV-PCR+女性的妊娠率显著降低(5%(2/40)对32.5%(13/40)对47.5%(19/40))。此外,研究人员报告了卵母细胞数量与HCV病毒载量之间的负相关(Hanafi等人,2011年)。
一项前瞻性病例对照研究包括22对HCV血清不一致夫妇和42名未感染对照,比较了IVF-ICSI的生殖结局。HCV血清不一致的夫妇和对照组在受精率(71.1%对70.2%)、植入率(5.1%对9.6%)、每次胚胎移植的临床妊娠率(10.8%对12.8%)或出生的孩子数(2/22对4/42)方面没有统计学差异(Prisant等,2010)。
一项回顾性队列研究比较了42对HCV血清不一致夫妇和84对匹配的非感染夫妇IVF-ICSI周期的结果。HCV血清不一致夫妇与对照组在受精率(56.4%对59%)、着床率(19%对19.2%)和每次胚胎移植妊娠率(28.5%(8/28)对29.3%(22/75))方面无统计学差异。然而,在HCV血清不一致的夫妇中,明显有更多的周期被取消(Englert等人,2007年)。
另一项回顾性队列研究包括12对HCV血清不一致(9名男性和3名女性HCV感染者)和27对未感染夫妇,调查了IVF-ICSI的生殖结局。HCV血清不一致夫妇和对照夫妇之间的受精率没有统计学差异(63.9%对75.9%),但是,每个周期的临床妊娠率有显著差异(0%(0/12)对41%(11/27))(Pirwany等人,2004年)。
结论
在评估女性HCV感染对不孕症治疗结果的影响时,有相互矛盾的结果。尽管一些研究报告HCV阳性女性的植入率显著降低,周期取消率更高,FSH使用率更高,但其他研究报告没有显著差异。
B4 预防/减少辅助生殖期间的传播
PICO问题:在MAR期间,哪些技术可用于预防/减少丙型肝炎病毒的传播?
精液处理
有关精液处理的证据将在下一节(B5)中详细讨论。
抗病毒治疗
没有关于抗病毒治疗和MAR的研究。
结论
目前尚无数据表明,对于未同时感染HCV的男性或女性,抗病毒治疗需要MAR以降低HCV传播的风险。目前所有可用的丙型肝炎病毒抗病毒药物都没有在怀孕期间使用的许可证。
B5精液处理
PICO问题:精液处理降低丙型肝炎病毒载量的最佳技术是什么?
根据
在93对需要ICSI的HIV、HCV或HBV阳性男性夫妇的子组中,23对HCV阳性男性夫妇(包括1对HCV一致性夫妇)进行了分析。通过密度梯度(80-40%)离心和洗涤处理精液,然后在ICSI前实时PCR检测HIV RNA、HCV RNA和HBV DNA。洗涤后的精液样本中没有HCV RNA阳性。48个ICSI周期产生了8个孩子,在这些妇女或她们的孩子中未检测到HCV血清转化(Molina等人,2014年)。
一项小型队列研究,包括35对HCV血清不一致(男性感染)夫妇,报告在IUI和ICSI后没有血清转化。精液通过密度梯度离心处理,swimup在处理后未进行PCR检测(Savasi等人,2013年)。
在一项针对16名HCV/HIV-1检测呈阳性的男性的小型队列研究中,需要MAR,通过密度梯度离心(80-40%)进行精液处理,清洗并向上游动。仅在密度梯度后,精浆和非精子细胞中发现HCV RNA(31.5%)。游泳前后所有清洗过的活动精子样本均为HCV RNA阴性(Savasi等人,2010年)。
一项前瞻性队列研究包括86对HCV血清不一致的夫妇(76名男性HCV阳性,10名男性HCV/HIV阳性)。精液通过密度梯度(90-70-50%)离心和上浮处理。20.4%的精浆样本HCV RNA阳性。所有精子组分均为HCV RNA阴性。这些婴儿在出生后3个月进行了丙型肝炎病毒检测,而女性则没有进行检测。在135个MAR周期(10个IVF、78个ICSI、12个冷冻胚胎移植、35个IUI周期)中,有36例怀孕,28例活产,没有一例婴儿检测出HCV阳性(Bourlet et al.,2009)。
在一项对7名检测出HCV阳性的男性(6名HIV/HCV阳性,1名HCV阳性)进行的小型队列研究中,精子经过1:1(体积/体积)稀释和离心处理,然后进行两次1:1稀释的颗粒和离心处理,没有进行游动。7份精子样本为HCV阴性,1份HCV PCR数据不可用(Garrido等人,2006年)。
在另一项研究中,来自20名HIV/HCV检测呈阳性且不需要MAR的男性的小群体精液样本被分成两份。一个精子总数和一个密度梯度(90-45%)离心。离心后产生三个精液部分(精浆、非活动细胞和活动精子)。将100微升的三种组分进行病毒学分析,并将900微升的三种组分洗涤3次,然后将活精子组分向上游动。5%(1/20)的精子检测HCV阳性。三个预洗精液组分中0%HCV阳性。0%的洗后精液部分HCV阳性(Canto等人,2006年)。
在一项队列研究中,32名男性检测出需要MAR的HCV阳性(HIV和HBV阴性),在三层密度梯度离心后,用经证实的HCV阴性精子进行了11个MAR周期。5名妇女怀孕,9名婴儿出生,出生时或6个月大时均未发现HCV阳性。女性没有进行丙型肝炎病毒检测(Bourlet等人,2002年)。
一项队列研究对35对需要MAR的不孕夫妇进行了研究,其中男性伴侣的HCV检测呈阳性,无HBV或HIV合并感染,其中50份冷冻解冻的精液样本在精液处理后使用密度梯度(90-45%)离心。只有90%的密度梯度分数用于IVF周期(n=26)和ICSI周期(n=24)。14%的精液HCV RNA阳性。45%组分中2%为HCV RNA阳性,90%组分中0%为HCV RNA阳性。所有HCV阳性精液样本中的HCV病毒载量均低于600 IU/ml。IVF或ICSI后,没有妇女或儿童检测出HCV阳性(Cassuto等人,2002年)。
一项前瞻性对照试验包括34名HIV检测呈阳性的男性,其中21名HCV检测呈阳性。精液样本通过三密度梯度离心处理,然后向上游动。巢式PCR检测12.2%的样本为HIV阳性,23.8%的样本为HCV阳性,而单轮PCR检测0%的样本为HIV阳性,0%的样本为HCV阳性(Meseguer等人,2002年)。
手术取出的精子
一项小型队列研究,包括4名患有梗阻性无精子症、无排卵症和隐精子症的丙型肝炎病毒检测阳性男性。两名男性接受了睾丸精子提取(TESE)和附睾显微手术精子抽吸(MESA),两名男性接受了TESE。通过密度梯度(90-45%)离心、精子颗粒再悬浮和离心制备附睾精子。通过在一层(45%)梯度上离心精子/培养基悬浮液,然后再悬浮精子颗粒并离心制备睾丸精子。MESA和TESE后的最终精子样本中未检测到HCV。ICSI后未将HCV传播给女性伴侣,并有1名健康婴儿出生(Leruez-Ville等人,2013年)。
正式建议
对于HCV检测呈阳性的患者,建议采用不连续梯度离心,然后刷洗和清洗精液。(强)⊕)
正当理由
在无合并感染的丙型肝炎病毒阳性男性中,没有发现将常规精液制备与高级精液处理(如梯度离心和向上游动)进行比较的研究。
目前的证据表明,单次连续密度离心或不经洗涤步骤的间断密度离心后,精液可以检测出HCV阳性。
PICO问题:是否需要对清洗后的精子进行PCR检测?
根据
在93对需要ICSI的HIV、HCV或HBV阳性男性夫妇中,有23对夫妇与HCV阳性男性(包括1对HCV一致性夫妇)进行了分析。通过密度梯度(80-40%)离心和洗涤处理精液,然后在ICSI前实时PCR检测HIV RNA、HCV RNA和HBV DNA。洗涤后,没有精液样本的HCV RNA呈阳性(Molina等人,2014年)。
在一项针对16名需要MAR的HCV/HIV1阳性男性的小型队列研究中,精液处理采用密度梯度离心法(80-40%),清洗并向上游动。仅在密度梯度后,精浆和非精子细胞中发现HCV RNA(31.5%)。游泳前后所有清洗过的活动精子样本均为HCV RNA阴性(Savasi等人,2010年)。
未完待续……