【摘要】 2023 年美国母胎医学会(SMFM)发布了妊娠期系统性红斑狼疮( SLE)的咨询文件,以便更好地发现 SLE 患者孕期并发症,规范其治疗与管理。 现就该共识进行简要解读以飨读者。
【关键词】 母胎医学会;系统性红斑狼疮;解读
系统性红斑狼疮( systemic lupus erythematosus,SLE) 是一种慢性、多系统、多脏器受累的炎性自身免疫性疾病,临床表现多种多样,常以疾病缓解和加重交替出现。 SLE 病变常涉及机体多个器官,临床表现多样,最常影响的是肾脏、关节及皮肤。 包括抗核抗体(antinuclear antibody,ANA)阳性的免疫指标异常也是 SLE 的特征。 据估计 SLE 的发病率为(28 ~150) / 100000,女性患者数倍于男性。 美国每年约有 3300例妊娠合并 SLE 患者。
目前 SLE 的发病机制尚不清楚,免疫异常、遗传因素、环境及激素可能在 SLE 的发生发展中发挥重要作用。 SLE 的诊断需临床表现与确切的实验室检查结果。 SLE 患者的临床症状发生率:乏力(80 ~ 100)% ,发热(80 ~ 100 )% ,关节炎 ( 80 ~ 95 )% ,肌痛 70% , 体重减轻60% ,光敏感性 60% ,颊部红斑 50% ,肾炎 50% , 胸膜炎50% ,淋巴结病 50% , 心包炎 30% , 神经精神症状 ( 20 ~30)% 。 因 SLE 临床表现多种多样,或缺乏确切的病理特征及实验室诊断标准,SLE 的诊断充满挑战。 目前通常用2019 年欧洲风湿病协会联盟/ 美国风湿病学会( EULAR/ACR)或系统性狼疮国际合作协会制定的分类标准诊断(表1、2)。
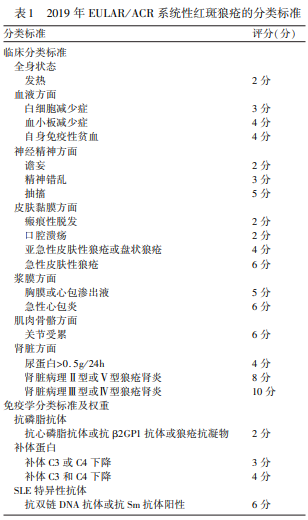

2019 年 EULAR/ ACR 系统性红斑狼疮的分类标准:(1)必备标准:ANA 滴度≥1 ∶ 80,如阴性不考虑 SLE,如存在,则考虑附加标准。 (2)附加标准:如该标准可被比 SLE更符合的其他疾病解释,不计分;标准至少出现一次即可;至少符合一条临床标准,总分≥10 分可分类诊断 SLE;标准不必同时发生。 在每个方面,只取最高权重标准得分计入总分。本指南采用了 2019 年 EULAR/ ACR 对于 SLE 的分类标准。
用于诊断 SLE 的实验室检查主要是 ANA、抗双链 DNA抗体(antibodies against double⁃stranded DNA,anti⁃dsDNA)、抗干燥综合征相关抗原 A/ B( anti⁃Sjogren's⁃syndrome⁃related an⁃tigen A,SSA/ SSB)、抗磷脂( antiphospholipid,aPL)抗体、补体水平、红细胞血沉、C⁃反应蛋白等。 SLE 可导致多种母体并发症,如狼疮性肾炎,血液系统并发症,如血小板减少症、抗磷脂综合征( antiphospholipid syndrome,APS)、血栓性疾病,中枢神经系统和神经系统并发症,皮肤性红斑狼疮等。据报道 SLE 导致的孕产妇死亡率增高 20 倍。
以下是 2023 年美国母胎医学会( Society for Maternal⁃Fe⁃tal Medicine,SMFM)对于妊娠合并 SLE 的管理建议。
1 建议 SLE 患者从妊娠 12 周开始服用低剂量阿司匹林直至分娩,以减少子痫前期的发生(1B 级)。
解读:SLE 可导致多种不良妊娠结局,如妊娠丢失、子痫前期、胎儿生长受限、早产的风险增加,且主要与胎盘低灌注相关。 SLE 患者的胎盘通常较小,伴血管病变,如蜕膜血管病变、血栓形成和梗死。
2 建议静止期外的其他 SLE 患者在妊娠期开始或继续服用羟氯喹(1B 级)。 对没有服用羟氯喹或其他药物的静止期患者,与风湿免疫科医生一起商议后,开始使用羟氯喹是合理的(2B 级)。
解读:研究表明,与妊娠期未服用羟氯喹的患者相比,服用羟氯喹患者的疾病活动性、泼尼松使用和不良妊娠结局(包括早产)机率降低。 然而,大多数研究并没有区分因妊娠而停止服用羟氯喹的患者和因疾病处于静止期而无需服用羟氯喹的患者。 目前还没有随机对照试验比较静止期 SLE孕妇服用或不服用羟氯喹的结局。 有研究者建议,对于抗SSA/ SSB 或 aPL 抗体阳性的静止期患者可考虑服用羟氯喹,因有研究表明这类人群使用羟氯喹后母胎不良妊娠结果有所改善。
3 建议孕期一般应避免长时间使用非甾体类抗炎药( >48h)(1A 级),由于类似的作用机制,建议孕期应避免使用COX⁃2 抑制剂和大剂量阿司匹林(1B 级),建议孕前至少 1 ~3 个月停用甲氨蝶呤和至少 6 周停用霉酚酸酯/ 霉酚酸(1A级)。
解读:妊娠期应避免使用几种治疗 SLE 的药物,其中包括非甾体类抗炎药,其可能对胎儿产生影响,如肾功能不全导致羊水过少、坏死性小肠结肠炎、动脉导管过早闭合和肺动脉高压。 麦考酚酸和甲氨蝶呤是致畸剂,禁止使用。
4 建议妊娠期与风湿免疫科专家一起个体化决定是否启动、继续或停止使用生物制剂(2C 级)。
解读:过去几年,新的生物制剂已被用于治疗一系列自身免疫性疾病如 SLE,其中肿瘤坏死因子 α 抑制剂( tumornecrosis factor⁃alpha inhibitors,TNF⁃α)和其他生物制剂,包括阿尼弗罗单抗和沃罗孢素。 但这些生物制剂用于妊娠期的安全性数据有限,因此,建议应与风湿免疫科专家一起个体化决定是否启动、继续或停止使用生物制剂。 目前,尚无数据表明在妊娠晚期停用这些药物可降低感染的风险,且如停药,应权衡妊娠晚期是否有发作的风险。
5 建议对于既往没有发生血栓且符合产科抗磷脂综合征诊断标准的患者,联合使用预防性普通肝素或低分子肝素及低剂量阿司匹林进行治疗(2B 级)。 建议针对有血栓形成和aPL 抗体阳性的患者,使用治疗性普通肝素或低分子肝素(1B 级)。
解读:对于 SLE 合并 APS 患者,妊娠期治疗的目标是改善孕产妇、胎儿和新生儿的预后。 符合 APS 临床和实验室标准的 SLE 患者应在妊娠期间和产后 6 周内进行预防性抗凝治疗。 对于既往有血栓形成的 APS 患者,建议在整个妊娠期和产后 6 周内进行治疗性抗凝治疗,以最大限度地降低母体血栓栓塞的风险。 美国妇产科学会建议,对于有死胎或复发性流产史的 SLE 和 APS 患者,应考虑在整个妊娠期和产后 6 周内预防性使用肝素。 根据患者病史、既往抗凝治疗情况和合并症的情况,抗凝药物剂量应个体化。
6 建议针对 aPL 抗体阳性但未达到 APS 诊断标准的 SLE 患者,可单独使用低剂量阿司匹林进行治疗(2C 级)。
解读:高达 40% 的 SLE 患者 aPL 抗体阳性,但只有 1 / 3的患者出现 APS 的临床表现。 对于 aPL 抗体阳性患者,尤其是狼疮抗凝物( lupus anticoagulants, LAC),虽不符合APS 的临床标准,仍有发生子痫前期的风险,但其他不良妊娠结局和理想的治疗方案仍不明确。
7 建议不需常规使用类固醇预防因 SSA/ SSB 抗体导致的胎儿心脏传导阻滞,因其有未经证实的益处和已知的风险(1C级)。 对 SSA/ SSB 抗体阳性患者,不需常规连续行胎儿超声心动图用于评估胎儿 PR 间期(1B 级)。
解读:SLE 可导致多种胎儿和新生儿不良结局,如新生儿红斑狼疮(neonatal lupus erythematosus,NLE),其主要临床表现为皮损、先天性心脏传导阻滞( congenital heart block,CHB)、贫血、肝炎和血小板减少症等。 无论是否诊断 SLE 或干燥综合征,只要孕妇存在抗 SSA 及抗 SSB 抗体,分娩 NLE新生儿的风险就会增加,这些抗体可通过胎盘,胎儿发生完全性 CHB 的风险约为 2% 。 后续妊娠胎儿可能受影响。有研究认为,在整个妊娠期使用羟氯喹可能会减少高危胎儿CHB 的发生。
另一种预防方法是筛查胎儿超声心动图,如发现Ⅰ型/ Ⅱ型 CHB,可应用类固醇治疗以防止进展为完全性 CHB。 虽然研究认为类固醇等抗炎药物可减少抗 SSA抗体引起的炎症和瘢痕,但是部分患者使用类固醇后病情仍有进展,并且可能发生羊水过少、胎儿生长受限、动脉导管闭锁等胎儿并发症,孕妇可能并发糖尿病、精神病等,因此不需常规使用类固醇预防胎儿 CHB。 目前,考虑到 CHB 缺乏有效的干预措施,因此,在抗 SSA/ SSB 抗体阳性的孕妇中筛查早期胎儿心脏传导阻滞的理由尚不充分。
8 建议 SLE 患者孕前咨询母胎医学和风湿免疫科专家,评估母儿相关风险(1C 级)。 有严重产科风险的患者,如活动性肾炎,严重肺部、心脏、肾脏或神经系统疾病,近期中风或肺动脉高压,一般不鼓励怀孕(1C 级)。 建议针对这类患者孕期常规产检并且筛查胎儿生长状况(1B 级)。
解读:孕前咨询可对疾病状况、孕产妇和胎儿风险进行临床和实验室评估,并调整孕产妇治疗方案。 应告知 SLE 患者,即使成功妊娠,也常会并发子痫前期、胎儿生长受限和早产。 此外,妊娠期可能会 SLE 急性发作,并且与非孕期相比,治疗方式更受限。 如可以妊娠,应至少在疾病缓解 6 个月后才开始备孕。 有严重产科风险的患者,如活动性肾炎,严重肺部、心脏、肾脏或神经系统疾病,近期中风或肺动脉高压,一般不鼓励怀孕。 因 SLE 孕妇胎儿生长受限和死胎的风险增加,孕期应常规产检且筛查胎儿生长状况。总之,SLE 是一种慢性多系统疾病,可导致母儿多种并发症。 对于 SLE 患者,需风湿免疫科及产科医生在孕前、孕期及产后共同管理,以改善母儿不良妊娠结局。
